Po superhalogenech přijdou hyperhalogeny
Chemie |
Halogeny mají mezi chemickými prvky největší elektronegativitu, přesto je ale možné připravit látky, které po doplnění svého elektronového obalu o jeden elektron touží ještě intenzivněji.
pravidelné páteční „přetištění“ staršího článku
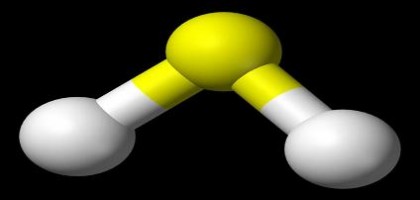
Již v 60. letech se ukázalo, že některé sloučeniny halogenů mají elektronovou afinitu ještě vyšší než samotné prvky. Fluorid platinový PtF6 dokonce dokázal přinutit k reakci i xenon – šlo o první sloučeninu vzácných plynů vůbec, až do té doby se věřilo, že jsou chemicky zcela inertní. V dalších desetiletích se podařilo připravit celou řadu ještě účinnějších superhalogenů, vždy šlo však o komplexy halogenů s kovy. Typicky může jít o běžné soli, k nimž se přidá atom halogenu navíc – např. NaCl2 chce urvat elektron ještě víc než samotný atom chloru (poznámka: jak takovou sloučeninu jako NaCl2 ale připravit?). Později se ukázalo, že jako superhalogeny mohou fungovat i některé oxidy.
Puru Yena a jeho (její?) kolegové z Virginia Commonwealth University, McNeese State University v Lake Charles z univerzity v německé Kostnici nyní dovedli popsaný postup o úroveň výš a vytvořili novou skupinu ještě elektronegativnějších sloučenin, které nazvali hyperhalogeny. Centrem molekuly je opět kov, kolem něj však nejsou samotné halogeny, ale už jejich komplexy – superhalogeny, resp. látky jejich typu. Testovaly se třeba vlastnosti molekuly, kde je v jádru atom zlata a kolem něj dvě molekuly oxidu boričitého (samo o sobě krajně obskurní sloučenina, těžko si představit její samostatnou existenci) – tedy Au(BO2)2. Komplex má mít elektronovou afinitu 5,7 eV (pro srovnání, samotný chlór má 3,6 eV). O Au(BO2)4 vědci věří, že by mohl mít afinitu až 7 a výhledově mají vědci za cíl dosáhnout až sloučenin s 10 eV.
Hyperhalogeny se mohou používat tam, kde nacházejí využití i halogeny obyčejné a super. V důsledku své obrovské reaktivity mohou fungovat třeba jako čisticí prostředky, bělidla či dezinfekce, samozřejmě ale účinněji než obyčejný chlór.
Zdroj: Eurekalert
Úvodní foto: Ben Mills, Wikipedia, licence public domain
Další články z rubriky
Související články
Tagy
chemické prvky · chlor · halogeny · sloučeniny
 Linkuj
| Jagg
| Delicious
| Facebook
| vybrali.sme.sk
Linkuj
| Jagg
| Delicious
| Facebook
| vybrali.sme.sk


Komentáře
Napsat vlastní komentář
Pro přidání příspěvku do diskuze se prosím přihlašte v pravém horním rohu, nebo se prosím nejprve registrujte.